
本系列连载内容将系统介绍医疗器械唯一标识(UDI)、UDI数据载体、UDI数据库及如何实施UDI等相关内容,为医疗器械企业解答基于GS1标准的UDI系统实施中可能遇到的问题,请大家持续关注。
医疗器械唯一标识(UDI)
1. 如何使用GS1标准编制UDI-DI?
答:UDI-DI可采用全球贸易项目代码(GTIN)进行标识。医疗产品GTIN常见结构有12、13和14位结构,国产产品常用结构为GTIN-13和GTIN-14,见下图。

其中GTIN-13用于单个销售单元包装,规则详见GB 12904 《商品条码 零售商品编码与条码表示》。GTIN-14一般用于多个销售单元的组合包装,规则详见GB/T 16830 《商品条码 储运包装商品编码与条码表示》。
此外,医疗器械GTIN的分配还应遵循《GS1医疗产品GTIN分配指南》,也可使用医疗GTIN分配在线决策工具帮助判断是否需要分配新GTIN。
2. 同一产品的不同包装级别UDI-DI应该不同吗?如何用GTIN进行标识?
答:不同包装级别应该用不同的UDI-DI,可使用如下两种方式进行标识:
(1)各包装级别使用不同的GTIN-13进行标识;
(2)最小销售单元包装使用GTIN-13,更高级别包装使用与最小销售单元相同产品项目代码,不同包装指示符的GTIN-14进行标识。
详见《GS1医疗产品GTIN分配指南》第四章。
3. 如何使用GS1标准编制UDI-PI?
答:UDI-PI可采用应用标识符(AI)表示,对应关系见下表。
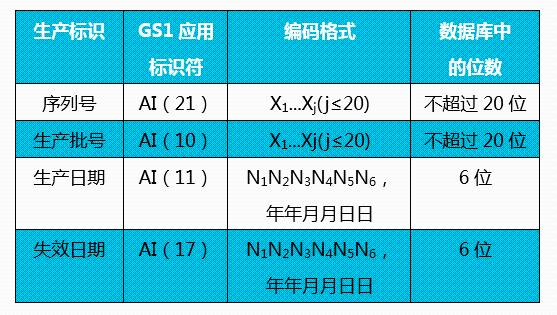
X为字母数字字符,N为数字。
编码规则详见GB/T 16986 《商品条码 应用标识符》。
4. UDI中应包含哪些UDI-PI?
答:生产标识……根据监管和实际应用需求,可包含医疗器械序列号、生产批号、生产日期、失效日期等。(《医疗器械唯一标识系统规则》第七条)
5. GS1标准的UDI中UDI-PI的顺序如何确定?
答:当UDI-PI中既有预定义长度应用标识符(如失效日期、生产日期),也有非预定义长度应用标识符(如批号、序列号)时,应将预定义长度应用标识符放在前面。
编码示例:
(01)06901234567892(11)141231(17)150707(10)A213B1(21)1234
规则详见《GS1通用规范》7.8.5.3 链接使用的其他注意事项。
6. 同一产品的不同批次可以使用相同的产品序列号吗?
答:不可以。根据GB/T 16986《商品条码 应用标识符》6.3.2,系列号……与GTIN结合唯一标识每个单独的项目。
7. 商品条码是UDI吗?两者是什么关系?
答:商品条码由一组规则排列的条、空及其对应代码组成,表示商品代码的条码符号,包括零售商品、储运包装商品、物流单元、参与方位置等等的代码与条码标识,商品条码编码体系(GS1编码体系)包括十余个国家标准,体系图如下。
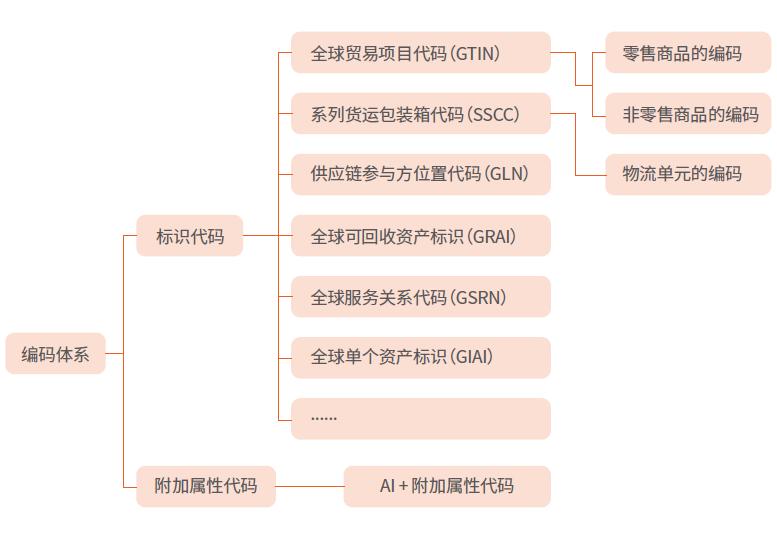
UDI是监管部门定义的医疗器械身份证,商品条码体系中的全球贸易项目代码(GTIN)和附加属性代码(应用标识符)等标准是可用于实施UDI的国家标准。
8. 器械出口欧盟要求提交的Basic UDI-DI,应该如何申请、编写?
答:在中国物品编码中心申请厂商识别代码后,可使用GS1全球型号代码(GMN, Global Model Number)标识符进行标识,GMN结构如下图,由厂商识别代码、型号参考代码和两个校验位组成,校验位可根据算法自行计算或在线生成,相关实施细节详见GS1欧盟UDI指南。

相关参考资料:
欧洲医疗技术协会(MedTech Europe’s)关于Basic UDI-DI 的实施指南
GS1总部网站UDI页面欧盟UDI部分
